全身性エリテマトーデス(SLE)、関節リウマチ(RA)、若年性特発性関節炎(JIA)や炎症性腸疾患(IBD)罹患女性患者の妊娠、出産を考えた治療指針に関して、ご説明いたします。
 妊娠中の薬剤で禁忌であるものと、安全性が示されているものは何か?
妊娠中の薬剤で禁忌であるものと、安全性が示されているものは何か?
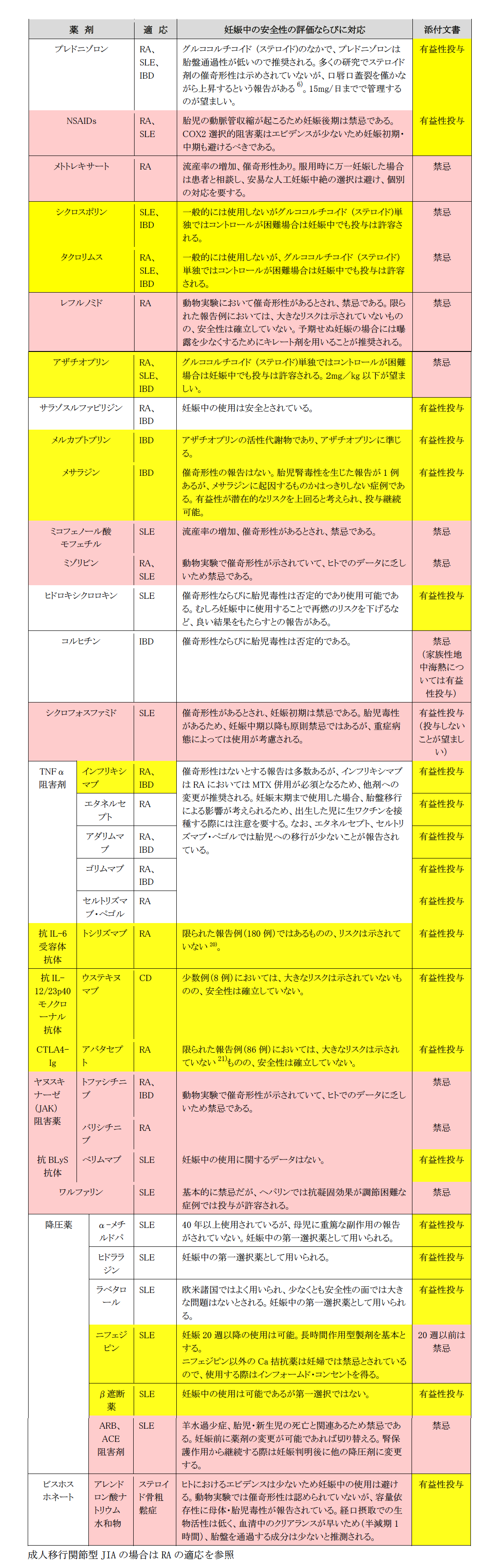
- メトトレキサート(MTX)、ミコフェノール酸モフェチルはヒトにおける催奇形性があるため禁忌である。(推奨度:B/同意度9)
- レフルノミド、ミゾリビンは動物実験で催奇形性が示されていることから禁忌である。(推奨度:C/同意度8)
- サラゾスルファピリジン、メルカプトプリン、ヒドロキシクロロキン、抗TNFα抗体製剤は、現時点で催奇形性が示されておらず、投与は許容される。(推奨度:B/同意度8)
- シクロスポリン、タクロリムス、アザチオプリンは病状がコントロール困難であれば、投与は許容される。(推奨度:B/同意度8)
- グルココルチコイド (ステロイド)に関しては胎盤移行性の低いプレドニゾロンが推奨される。(推奨度:A /同意度9)
- 妊娠中の降圧剤に関してヒドララジン、α-メチルドパ、ラベタロールは、安全性が示されているため投与可能である。(推奨度:B/同意度8)
- アンギオテンシンⅡ受容体拮抗薬(ARB)、アンジオテンシン変換酵素阻害薬(ACE阻害剤)は、胎児・新生児死亡と関連があり禁忌である。(推奨度:B/同意度8)
一般の出生児における先天性疾患の頻度は3-5%であり、その内訳は染色体疾患(25%)、単一遺伝子疾患(20%)、多因子遺伝(50%)、環境・催奇形因子(5%)などである1)。したがって薬剤による催奇形性の頻度が、一般の先天疾患の頻度3-5%よりも上昇するかが問題となる。また予期せぬ妊娠の際には、妊娠と薬に関するカウンセリングを受けること、胎児精密超音波検査でのフォローが推奨される。メトトレキサート(MTX)の妊娠中の使用は、流産率の増加(流産率:妊娠初期曝露群42.5%、非自己免疫疾患対照群17.3%)、催奇形性(大奇形率:妊娠初期曝露群6.6%、非自己免疫疾患対照群2.9%)が指摘されており2)禁忌であるため、少なくとも一月経周期より以前に、他の薬剤への変更が必要である。NSAIDは、妊娠後期で胎児の動脈管早期閉鎖の可能性があり禁忌である。MTX、ミコフェノール酸モフェチルはヒトにおいて催奇形性が示されているため使用しない。またレフルノミド、ミゾリビンは動物実験で催奇形性が示されおり、ヒトでのデータが乏しいので使用しない。
一方、サラゾスルファピリジン、メルカプトプリン、ヒドロキシクロロキン、抗TNFα抗体製剤は、現時点では、催奇形性は示されておらず投与可能である。ただし抗TNFα抗体製剤であるインフリキシマブはRAに関しては保険上、MTXとの併用が必須となるため、妊娠後に他の抗TNFα抗体製剤に変更することが推奨される3),4)。2016年に発表されたEULARのガイドライン(Points to consider for use of antirheumatic drugs in pregnancy)ではヒドロキシクロロキン、サラゾスルファピリジン、アザチオプリン、シクロスポリン、タクロリムス、コルヒチンなどの治療薬は、現時点では安全性が示されており、寛解維持のため妊娠中も中止をせず、継続すべき薬剤に分類されている3)。ただし本邦における薬剤添付文書では禁忌となっているものもあるので添付文書改定まではインフォームドコンセント(IC)を必要とする。
グルココルチコイド (ステロイド)に関してプレドニゾロンは胎盤通過性が低いため、推奨される5)。グルココルチコイドは、プレドニゾロン換算で15mg/日までで管理されていることが望ましい。多くの研究でプレドニゾロンの催奇形性は示されていなかった5)が、口唇口蓋裂が僅かながら上昇する(odds ratio 3.35 [95% CI 1.97, 5.69])という報告がある6)。このリスクの上昇をわかりやすく解説すると、通常口唇口蓋裂の発症頻度は、500人に1人であるが、妊娠初期にプレドニゾロンを使用した場合に、口唇口蓋裂の発症頻度が、500人に約3人に上昇する程度である。プレドニゾロンの高用量(1mg/kg/day以上)のグルココルチコイド 投与の場合は、糖尿病や高血圧、妊娠高血圧腎症、37週未満の前期破水のリスクを上昇させるという報告がある4)。また早産のリスクを上昇させるという報告もある7)-10)。
妊娠中の降圧剤に関してヒドララジン、α-メチルドパ、ラベタロールは、安全性が示されているため投与可能である。アンギオテンシンⅡ受容体拮抗薬(ARB)、アンジオテンシン変換酵素阻害薬(ACE阻害剤)の胎児毒性はあきらかで、胎児の腎機能異常により無尿を認め、羊水過小の原因となり、その結果として手足の形成異常、頭蓋形成異常、肺低形成などを起こすことがある。また子宮内胎児発育不全や早産、胎児死亡、新生児の重症低血圧、新生児死亡なども認める。これらの一連の症状をACE阻害薬胎児病と称する11)。ACE阻害剤についての催奇形性は、2006年にCoorperら12)が、ACE阻害剤の妊娠初期暴露群で奇形発生リスクが上昇(RR,2.71;95%CI 1.72-4.27)することを報告したが、その後ACE阻害剤の催奇形性を否定する報告13)-15)が相次いだ。また2017年にBatemanら16)は、妊娠初期のACE阻害剤の暴露群4,107例の検討で、その催奇性を否定する報告をした。したがってACE阻害薬の催奇形性について一定の見解が得られていないのが現状である。またARBに関してはACE阻害薬よりさらに疫学研究データが少ない。いずれの薬剤においても中期・後期での胎児毒性はあきらかなため妊娠が判明した場合には速やかに他の降圧剤に変更するべきである。
※男性患者の内服薬剤と妊娠
MTXの添付文書には、精子形成には3ヵ月を要するため、男性側は、MTXを投与中および投与終了後3ヶ月は妊娠をさけるよう注意を与えると記載されている。しかし、MTXの男性側の使用による胎児への影響については、小規模ながら児への有害事象を上昇させないという報告がある17)18)。
また、レフルノミドの添付文書には、ラットにおける雄性生殖能試験において胎児に影響はみられなかったが、リスクを最小限にするために挙児を希望する男性には、本剤の投与の中止及び薬物除去を考慮することと記載されている。いずれにしても、症例数が少ないため、明確な指針をここでは示さないが、以上について挙児を考えるようになった際に十分に説明しておくことは意義があると考えられる。
以下に妊娠中の薬剤のリスクを示す。
-
<参考文献>
- 1) Thompson & Thompson Genetics in Medicine (8th ed.)
- 2) Weber-Schoendorfer C, Chambers C, Wacker E, Beghin D, Bernard N; Network of French Pharmacovigilance Centers, Shechtman S, Johnson D, Cuppers-Maarschalkerweerd B, Pistelli A, Clementi M, Winterfeld U, Eleftheriou G,Pupco A, Kao K, Malm H, Elefant E, Koren G, Vial T, Ornoy A, Meister R, Schaefer C. Pregnancy outcome after methotrexate treatment for rheumatic disease prior to or during early pregnancy: a prospective multicenter cohort study. Arthritis Rheumatol. 2014 ;66(5):1101-1110.
- 3) Gotestam Skorpen C, Hoeltzenbein M, Tincani A, et al. The EULAR points to consider for use of antirheumatic drugs before pregnancy, and during pregnancy and lactation. Ann Rheum Dis. 2016;75:795-810.
- 4) Porter ML, Lockwood SJ, Kimball AB. Update on biologic safety for patients with psoriasis during pregnancy. Int J Womens Dermatol. 2017;3:21-25.
- 5) G.G.Briggs, R.K.Freeman, C.V.Towers, et al. Drugs in Pregnancy & Lactation, 11th ed. LIPPINCOTT WILLIAMS & WILKINS. 2017
- 6) Park-Wyllie L, Mazzotta P, Pastuszak A, Moretti ME, Beique L, Hunnisett L,Friesen MH, Jacobson S, Kasapinovic S, Chang D, Diav-Citrin O, Chitayat D, Nulman I, Einarson TR, Koren G. Birth defects after maternal exposure to corticosteroids: prospective cohort study and meta-analysis of epidemiological studies. Teratology. 2000;62(6):385-392.
- 7) Ostensen M, von Esebeck M, Villiger PM. Therapy with immunosuppressive drugs and biological agents and use of contraception in patients with rheumatic disease. J Rheumatol. 2007;34:1266-1269.
- 8) Cowchock FS, Reece EA, Balaban D, et al. Repeated fetal losses associated with antiphospholipid antibodies: a collaborative randomized trial comparing prednisone with low-dose heparin treatment. Am J Obstet Gynecol. 1992;166:1318-1323.
- 9) Silver RK, MacGregor SN, Sholl JS, et al. Comparative trial of prednisone plus aspirin versus aspirin alone in the treatment of anticardiolipin antibody-positive obstetric patients.Am J Obstet Gynecol. 1993;169:1411-1417.
- 10) Shiozaki A, Yoneda S, Nakabayashi M, et al. Multiple pregnancy, short cervix, part-time worker, steroid use, low educational level and male fetus are risk factors for preterm birth in Japan: a multicenter, prospective study. J Obstet Gynaecol Res. 2014;40:53-61.
- 11) Barr M Jr. Teratogen update: angiotensin-converting enzyme inhibitors.Teratology. 1994;50(6):399-409.
- 12) Cooper WO, Hernandez-Diaz S, Arbogast PG, Dudley JA, Dyer S, Gideon PS, Hall K, Ray WA. Major congenital malformations after first-trimester exposure to ACE inhibitors. N Engl J Med. 2006;354(23):2443-2451.
- 13) Li DK, Yang C, Andrade S, Tavares V, Ferber JR. Maternal exposure to angiotensin converting enzyme inhibitors in the first trimester and risk of malformations in offspring: a retrospective cohort study. BMJ. 2011;343:d5931.
- 14) Moretti ME, Caprara D, Drehuta I, Yeung E, Cheung S, Federico L, Koren G. The Fetal Safety of Angiotensin Converting Enzyme Inhibitors and Angiotensin II Receptor Blockers. Obstet Gynecol Int. 2012;2012:658310.
- 15) Walfisch A, Al-maawali A, Moretti ME, Nickel C, Koren G. Teratogenicity of angiotensin converting enzyme inhibitors or receptor blockers. J Obstet Gynaecol. 2011;31(6):465–472.
- 16) Bateman BT, Patorno E, Desai RJ, Seely EW, Mogun H, Dejene SZ, Fischer MA,Friedman AM, Hernandez-Diaz S, Huybrechts KF. Angiotensin-Converting Enzyme Inhibitors and the Risk of Congenital Malformations. Obstet Gynecol. 2017;129(1):174-184.
- 17) Weber-Schoendorfer C, Hoeltzenbein M, Wacker E, Meister R, Schaefer C. No evidence for an increased risk of adverse pregnancy outcome after paternal low-dose methotrexate: an observational cohort study. Rheumatology (Oxford). 2014;53(4):757-763.
- 18) Beghin D, Cournot MP, Vauzelle C, Elefant E. Paternal exposure to methotrexate and pregnancy outcomes. J Rheumatol. 2011;38(4):628-632.
- 19) Hoeltzenbein M, Beck E, Rajwanshi R, et al. Tocilizumab use in pregnancy: Analysis of a global safety database including data from clinical trials and post-marketing data. Semin Arthritis Rheum. 2016;46:238-245.
- 20) Kumar M, Ray L, Vemuri S, et al. Pregnancy outcomes following exposure to abatacept during pregnancy. Semin Arthritis Rheum. 2015;45:351-356.




 妊娠中の薬剤リスクのダウンロード[113KB]
妊娠中の薬剤リスクのダウンロード[113KB]